Comment fonctionne et comment est construite une batterie ?
Table des matières
La fonction traditionnelle de la batterie dans le compartiment moteur est bien connue : sans la batterie, le véhicule ne peut pas démarrer. Outre le démarreur, les bougies d’allumage, les bougies de préchauffage, les lumières et les applications électroniques requièrent toutes de l’énergie électrique. Comment la batterie est-elle construite et comment fonctionne-t-elle ?
Les batteries plomb-acide : composants et structure
De nombreux conducteurs s’aperçoivent que les batteries automobiles sont lourdes lorsqu’ils achètent une nouvelle batterie. Leur poids peut aller de 10,5 kg à 30 kg. Ce sont les plaques de plomb dans les éléments de batterie qui en sont la cause.
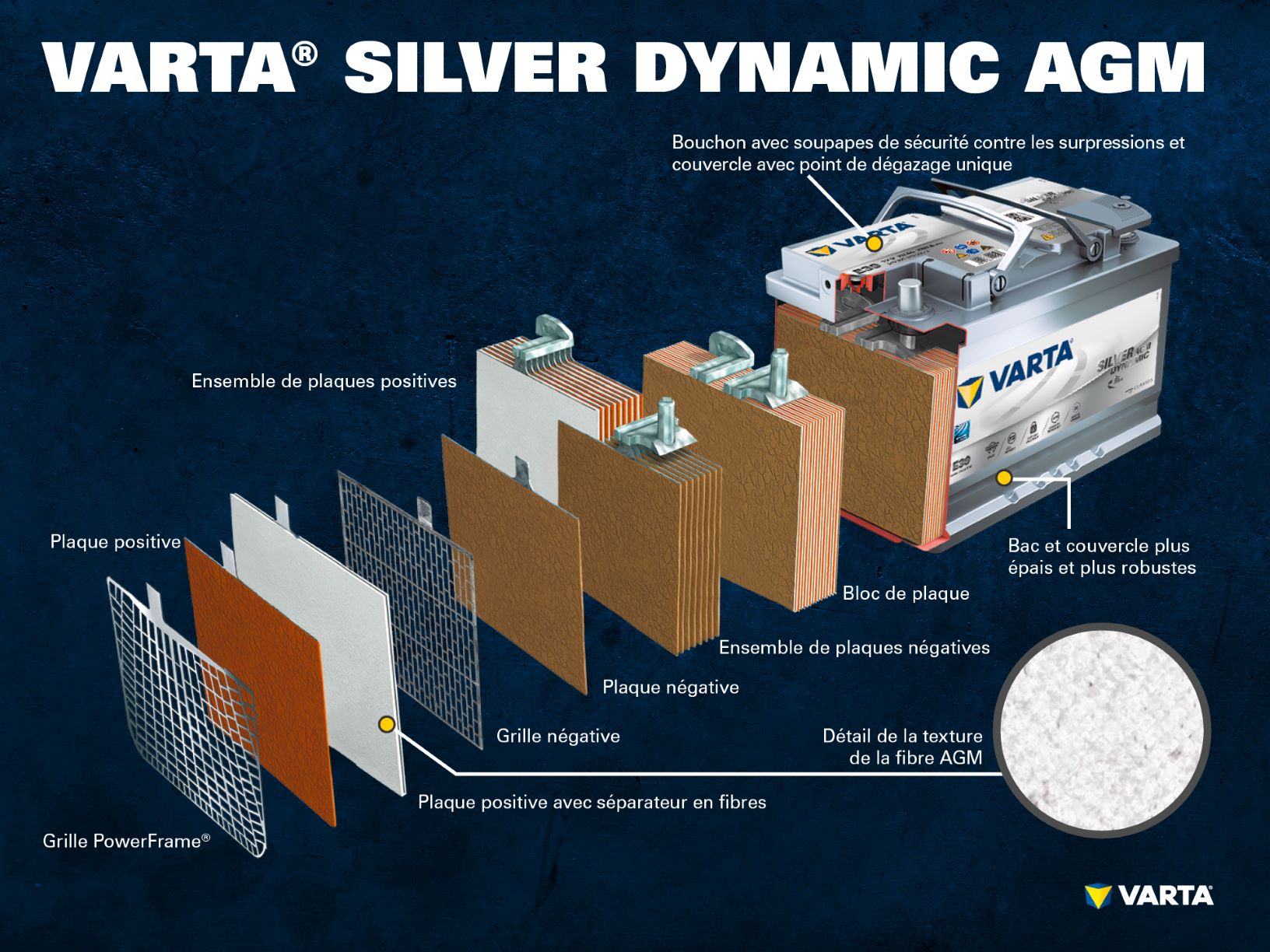
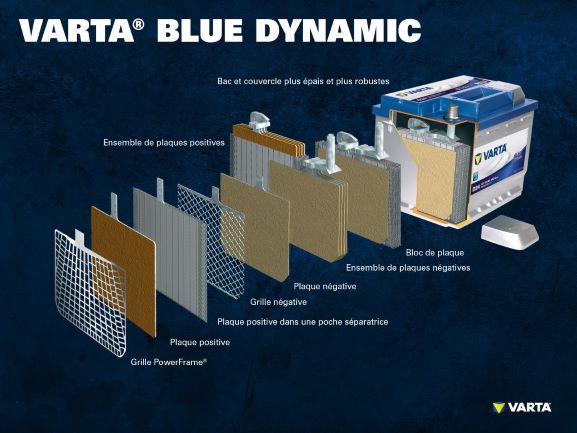
Composants et structure d’un élément de batterie
Électrode positive :
- Plaque positive : dans une batterie plomb-acide, la plaque chargée positivement (matière active) se compose d’oxyde de plomb (PbO2) immergé dans un électrolyte.
- Grille positive : la grille positive se compose d’un alliage de plomb ; elle est utilisée pour contenir la matière active et comme collecteur de courant.
Électrode négative :
- Plaque négative : la plaque chargée négativement (matière active) se compose de plomb pur (Pb), qui est également immergé dans un électrolyte.
- Grille négative : comme la grille positive, celle-ci se compose d’un alliage de plomb et a la même fonction.
Les électrodes avec des charges différentes sont séparées par un sac séparateur.
L’électrolyte est un mélange d’acide sulfurique (H2SO4) et d’eau distillée. Il peut être sous forme liquide (comme dans les batteries liquides conventionnelles ou avec la technologie EFB améliorée), sous forme de gel ou absorbé par un séparateur en fibre de verre (comme avec la technologie AGM pour les applications Start-Stop récentes).
Un ensemble de plaques positif est formé par plusieurs électrodes positives, et un ensemble de plaques négatif par plusieurs électrodes négatives. Les ensembles de plaques positif et négatif constituent un bloc de plaques. Ce bloc de plaques est un élément de batterie.
Une batterie de démarrage conventionnelle se compose de 6 éléments connectés en série, chacun ayant une tension nominale de 2 V et générant une tension totale de 12,72 V exactement, lorsque la batterie est entièrement chargée. La capacité et l’aptitude au démarrage à froid de la batterie sont fonction du nombre de plaques par élément.
Les éléments sont contenus dans un boîtier qui est en plastique résistant aux acides (polypropylène). Sur une batterie SLI conventionnelle, le boîtier est fermé avec un couvercle muni d’un système à labyrinthe empêchant le liquide de la batterie de s’échapper et séparant le liquide et le gaz.
Les anciennes batteries avaient des bouchons vissés, ce qui permettaient de les remplir avec de l’eau distillée. Les batteries modernes ne nécessitent aucun entretien. Non seulement il n’est pas nécessaire de faire l’appoint d’eau, mais il ne faut surtout pas le faire. Bien que les batteries AGM aient encore des « bouchons à usage unique », ceux-ci ne doivent être ouverts en aucun cas.
Fonctionnement des batteries de voiture : l’énergie chimique est transformée en énergie électrique
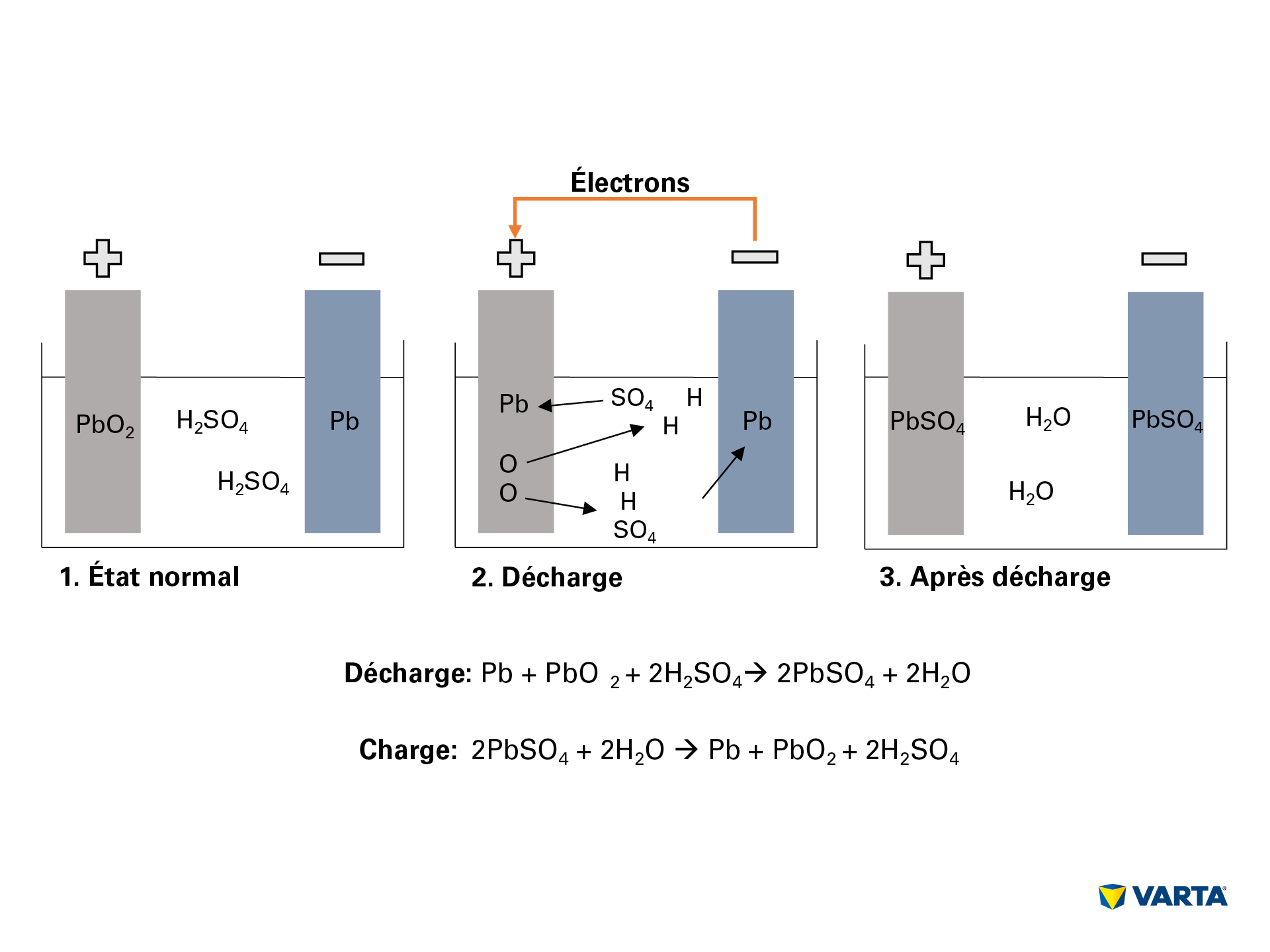
Une batterie de voiture stocke l’énergie sous forme chimique et la convertit en énergie électrique. Au cours de ce processus électrochimique, quatre éléments réagissent entre eux :
– l’hydrogène (H)
– l’oxygène (O2)
– le plomb (Pb)
– le soufre (S)
La connexion d’un consommateur externe démarre la réaction chimique dans la batterie :
- L’électrolyte, un mélange d’acide sulfurique (H2SO4) et d’eau distillée, se décompose en ions hydrogène chargés positivement (H+) et en ions sulfate chargés négativement (SO42-).
- Simultanément, des électrons (2e–) passent de l’électrode négative à l’électrode positive, par le consommateur externe.
- Pour compenser ce flux d’électrons, des ions sulfate passent de l’électrolyte à l’électrode négative, où ils réagissent avec le plomb (Pb) pour produire du sulfate de plomb (PbSO4).
- Du sulfate de plomb est également produit au niveau de l’électrode positive : la liaison entre l’oxygène (O2) et l’oxyde de plomb (PbO2) est brisée par le transfert d’électrons et l’oxygène passe dans l’électrolyte. Le plomb (Pb) restant se combine avec le sulfate (SO4) de l’électrolyte.
- Dans l’électrolyte, l’oxygène se combine avec l’hydrogène pour former de l’eau (H2O). Au fur et à mesure que l’acide sulfurique est consommé par la formation du sulfate de plomb, la concentration de la solution d’électrolyte baisse. Lorsque la concentration d’acide sulfurique tombe sous un certain seuil, la batterie doit être rechargée.
- Pendant la charge, ce processus chimique est effectué dans le sens inverse. Lorsqu’il est terminé, on retrouve les composants initiaux : l’électrode positive se compose de sulfate de plomb (PbSO4), l’électrode négative de plomb pur (Pb) et l’électrolyte d’acide sulfurique dilué (H2SO4).
Comme ce processus de conversion s’accompagne de pertes, une batterie ne peut supporter qu’un nombre limité de cycles de charge. Par conséquent, sa durée de vie utile est limitée.
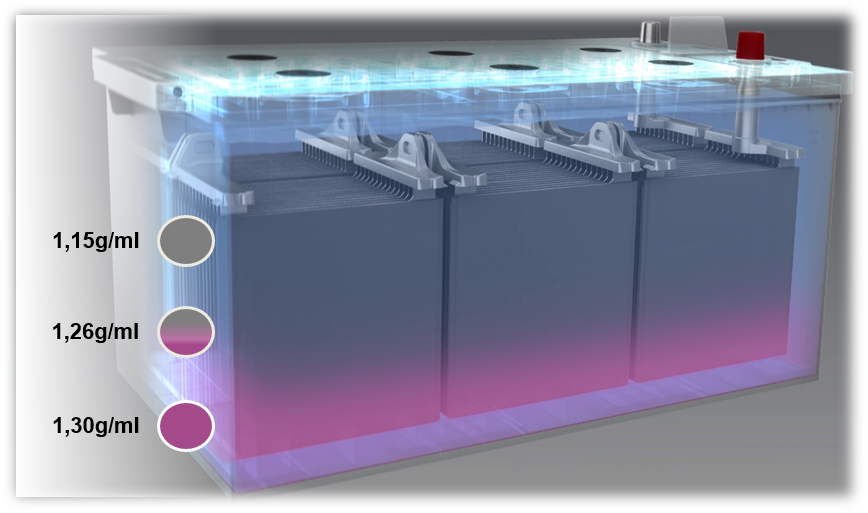
Problèmes se produisant sur les batteries plomb-acide : la sulfatation et la stratification d’acide
Si une batterie est chargée avec une tension qui est trop faible, ou si elle fonctionne toujours à une tension trop faible (inférieure à 80 %), une stratification de l’acide peut se produire. L’acide dans l’électrolyte se mélange mal et se stratifie. Des différences de densité entraînent une stratification, l’acide sulfurique se trouvant dans la zone du fond de la batterie et l’eau dans la zone supérieure. Pour cette raison, seule la zone du milieu de l’électrolyte – c’est-à-dire uniquement un tiers – peut être utilisée pour les processus de charge et de décharge.
Ce sont principalement les trajets courts avec utilisation simultanée d’un grand nombre de consommateurs électriques qui sont une des causes possibles de la stratification d’acide. Dans ce cas, l’alternateur n’a pas suffisamment de temps pour recharger la batterie.
La sulfatation est une conséquence de la stratification d’acide. Si une stratification se produit dans la batterie, ou si celle-ci n’est pas constamment chargée à un niveau adéquat, le sulfate de plomb (PbSO4) se cristallise sur les électrodes, formant avec le temps des structures cristallines de grande taille. Ce processus s’appelle la « sulfatation ». La cristallisation empêche la reconversion du sulfate de plomb en plomb ou en oxyde de plomb, les composants initiaux ; cela se traduit par une limitation de l’acceptation de charge et par une réduction de la puissance de démarrage à froid.
Par ailleurs, des cristaux coupants peuvent également endommager les séparateurs ou provoquer des courts-circuits dans les éléments.
Pour contrer cet effet et empêcher l’apparition prématurée d’une panne, le niveau de charge d’une batterie ne doit jamais être trop bas sur une longue période. À cette fin, il est recommandé de tester régulièrement la batterie et de la charger totalement si nécessaire.
Vous souhaitez en savoir plus sur ce sujet ? Comment charger une batterie correctement.
Nouvelles technologies de batteries : AGM et lithium-ion
Jusqu’à aujourd’hui, les batteries plomb-acide conventionnelles ont représenté une part importante du marché. Toutefois, ce marché évolue rapidement : des technologies de batteries innovantes pour les véhicules Start-Stop, telles que les AGM, utilisent l’acide qui est absorbé par une membrane afin de fournir une plus grande stabilité de cyclage et de garantir une performance fiable sur les véhicules avec des besoins en énergie plus importants. Un autre avantage des AGM : grâce à l’absorption de l’acide, la stratification n’est plus possible.
Une nouvelle génération de batteries de voitures pour véhicules micro-hybrides fonctionne en 48 V et utilise des éléments avec technologie lithium-ion.