Come funziona una batteria e come è composta?
Questo articolo è strutturato nel seguente modo:
Il compito di una batteria è ben noto: l’avvio del motore. Il motorino di avviamento, le candele di accensione e d’incandescenza, le luci del veicolo e gli assistenti elettronici necessitano di energia elettrica. Ma come si compone una batteria e come funziona?
La batteria piombo-acido: componenti e struttura
Molti automobilisti che acquistano una nuova batteria per la loro automobile sanno quanto è pesante: da 10,5 kg a 30 kg. Questo peso è causato dalle piastre di piombo nelle celle della batteria.
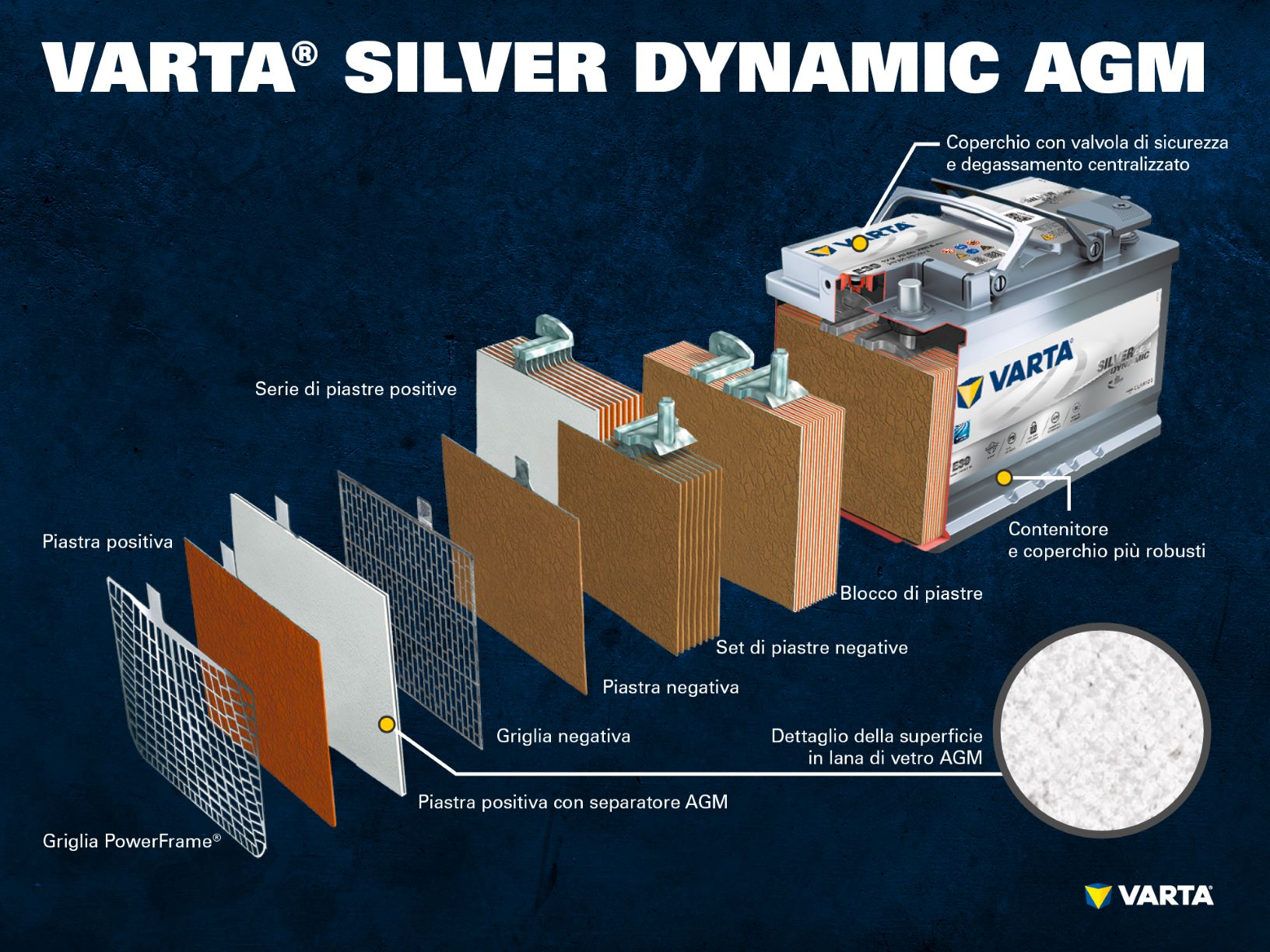
Componenti e struttura della cella di una batteria
Elettrodi positivi:
- Piastra positiva: la piastra positiva (massa attiva) è costituita nella batteria piombo-acido da biossido di piombo (PbO2) immersa nell’elettrolita.
- Griglia positiva: la griglia positiva consiste di una lega di piombo. Serve ad accogliere la massa attiva e come conduttrice di elettricità.
Elettrodo negativo:
- Piastra negativa: la piastra negativa (massa attiva) consiste di piombo puro (Pb). Anch’essa è immersa in un elettrolita.
- Griglia negativa: anch’essa consiste di una lega di piombo e ha lo stesso scopo.
L’elettrodo negativo è separato da quello positivo da un separatore.
L’elettrolita è costituito di acido solforico e di acqua distillata (H2SO4). L’elettrolita può essere liquido (classiche batterie a cella umida o batterie EFB), gelatinoso oppure assorbito in un feltro (batterie AGM per sistemi start-stop).
Una serie di elettrodi positivi forma un set di piastre positive. Una serie di elettrodi negativi forma un set di piastre negative. Un set di piastre negative e un set di piastre positive formano un blocco di piastre. Un blocco di piastre costituisce la cella della batteria.
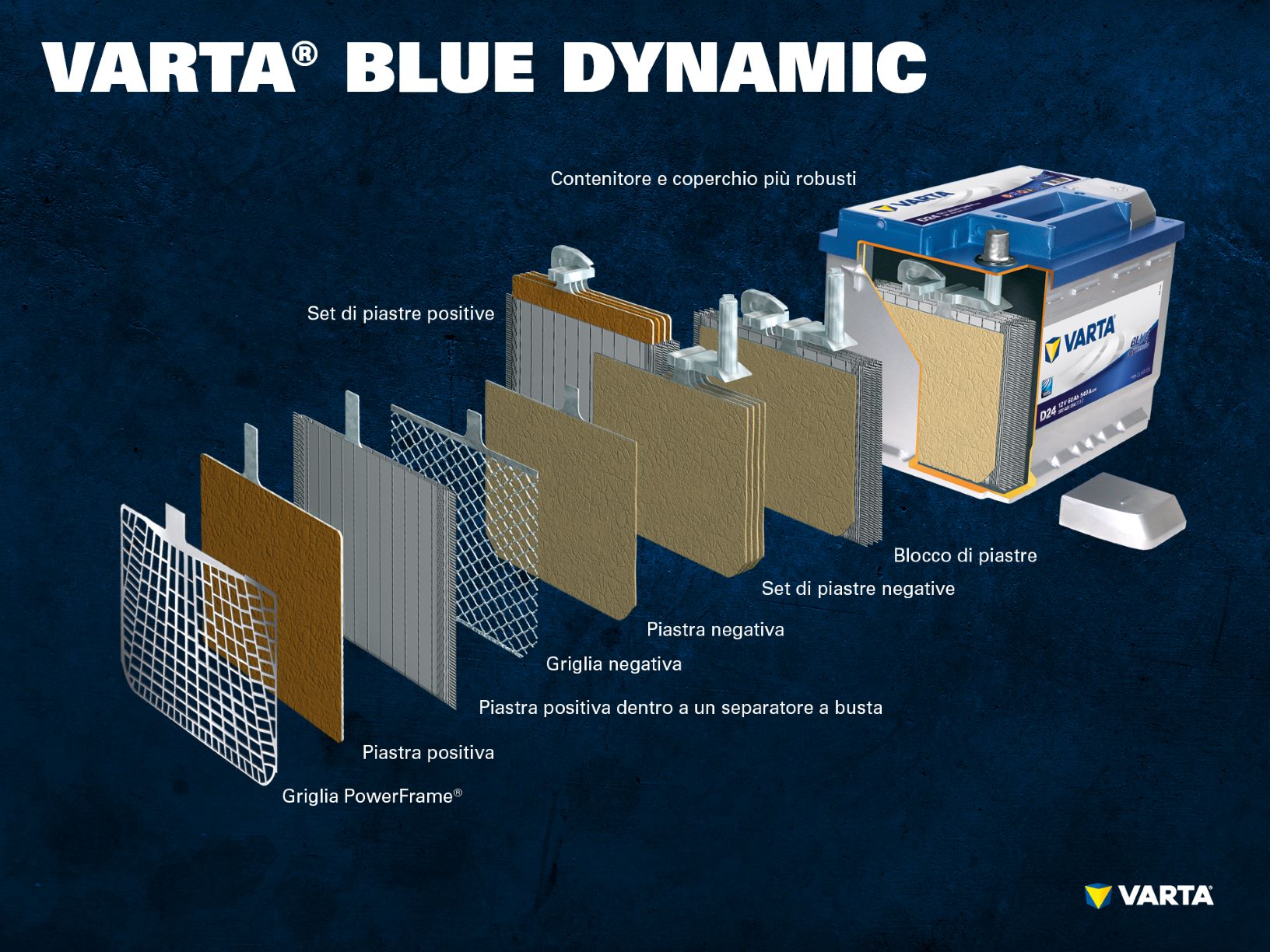
Una tradizionale batteria di avviamento consiste di un collegamento in serie di 6 celle con una tensione nominale di 2 V ciascuna. Quando la batteria è completamente carica produce una tensione di 12,72 V. Il numero di piastre per singola cella determina la capacità della batteria e la corrente di spunto.
Regola generale: la capacità di spunto a freddo (CCA) della batteria è tanto maggiore, quante più piastre si trovano nella cella, in quanto esse formano una superficie maggiore. Se invece si sfrutta lo spazio della cella per inserirvi meno piastre ma più spesse, si aumenterà la resistenza ai cicli e la batteria sopporterà un numero maggiore di cariche/scariche.
Le celle si trovano all’interno di un contenitore di plastica (polipropilene) resistente agli acidi. Nelle classiche batterie SLI questo contenitore è dotato di un coperchio a labirinto che impedisce la fuoriuscita del liquido della batteria e separa il liquido dal gas.
Le vecchie batterie erano dotate di tappi grazie ai quali era possibile rabboccare la batteria con acqua distillata. Le batterie moderne non necessitano di alcuna manutenzione e non devono essere rabboccate. Le batterie AGM sono dotate di una valvola di sicurezza e non devono essere mai aperte.
Funzionamento di una batteria: l’energia chimica viene convertita in energia elettrica
Una batteria accumula energia in forma chimica e la converte in energia elettrica. Si tratta di un processo elettrochimico nel quale reagiscono quattro diversi materiali:
- Idrogeno (H)
- Ossigeno (O2)
- Piombo (Pb)
- Zolfo (S)
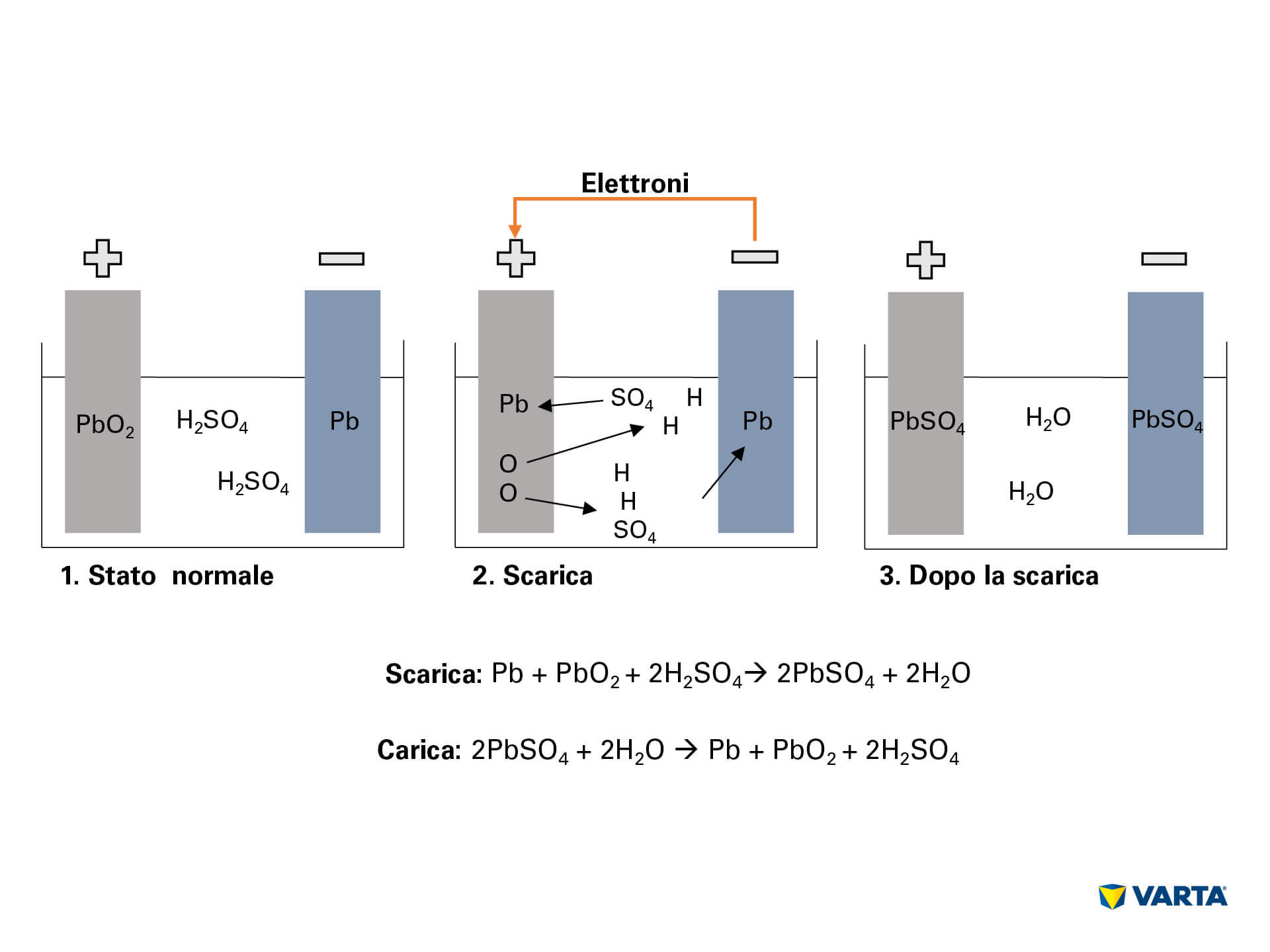
Collegando la batteria a un utilizzatore esterno si innesca la reazione chimica della batteria:
- L’elettrolita, una miscela di acido solforico e acqua distillata (H2SO4), si dissocia in ioni d’idrogeno positivi (H+) e ioni di solfato negativi (SO42-).
- Gli elettroni (2e) fluiscono dall’elettrodo negativo a quello positivo attraverso l’utilizzatore esterno.
- Per compensare questo flusso di elettroni, gli ioni di solfato fluiscono dall’elettrolita all’elettrodo negativo, reagiscono con il piombo (Pb) e formano solfato di piombo (PbSO4)
- Anche sull’elettrodo positivo si forma solfato di piombo: in conseguenza del flusso degli elettroni, l’ossigeno (O2) si lega al biossido di piombo (PbO2). L’ossigeno passa quindi all’elettrolita. Il restante piombo (Pb) si lega con il solfato (SO4) presente nell’elettrolita.
- L’ossigeno si lega con l’idrogeno formando acqua (H2O). Poiché l’acido solforico viene consumato nella formazione del solfato di piombo, si riduce la concentrazione della soluzione elettrolitica. Appena la concentrazione dell’acido solforico scende sotto a un certo livello, la batteria dovrà essere ricaricata.
- Durante la carica i processi chimici avvengono in senso inverso. Alla fine si ritroveranno gli elementi originari: l’elettrodo positivo consistente di solfato di piombo (PbSO4), l’elettrodo negativo di piombo puro (Pb) e l’elettrolita di acido solforico diluito (H2SO4). Poiché questo processo comporta perdite, ogni batteria può resistere solo a un limitato numero di cicli. La sua durata è pertanto limitata.
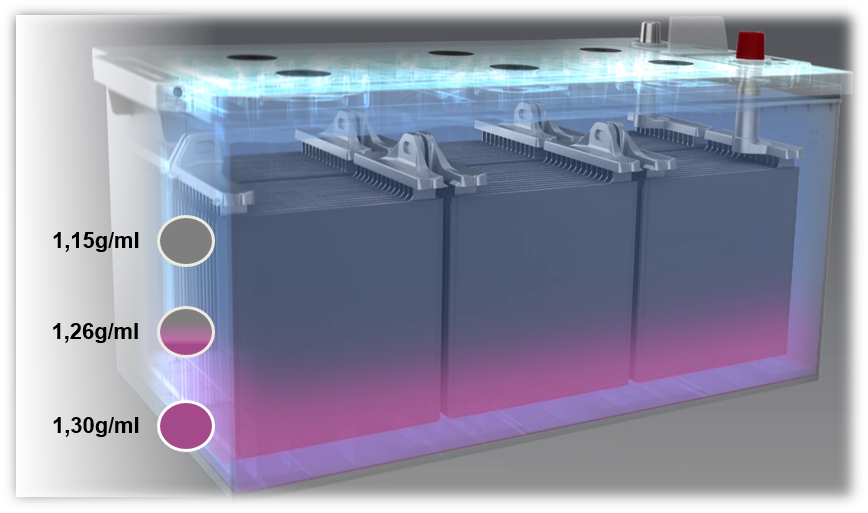
Problemi delle batterie piombo-acido: solfatazione e stratificazione dell’acido
Se la batteria viene caricata con una tensione insufficiente o se funziona sempre a una bassa tensione (inferiore all’80%) si avrà stratificazione dell’acido. L’acido si stratifica nell’elettrolita per la mancata omogeneità della miscela. A causa della diversa densità dell’acido e dell’acqua, l’acido si deposita sul fondo mentre l’acqua si concentra in alto. Di conseguenza, solo la parte centrale dell’elettrolita (solo un terzo) potrà essere utilizzato per i processi di carica/scarica.
La stratificazione dell’acido può essere causata da frequenti tragitti brevi con un uso intenso di utilizzatori elettrici. L’alternatore non ha, in questo caso, il tempo necessario per la ricarica della batteria.


La stratificazione dell’acido produce solfatazione. Se sulla batteria si ha stratificazione, oppure se essa non viene regolarmente caricata sufficientemente, il solfato di piombo (PbSO4) si cristallizza sugli elettrodi e forma grossi cristalli. Si tratta del fenomeno denominato solfatazione. La cristallizzazione impedisce al solfato di piombo di riconvertirsi negli elementi originari (piombo o biossido di piombo) causando problemi di carica e una riduzione della capacità di avviamento a freddo.
Possono formarsi cristalli taglienti con possibili danni ai separatori o cortocircuiti nelle celle.
Per contrastare questi effetti e impedire un guasto prematuro della batteria è opportuno evitare cariche insufficienti della batteria per un lungo periodo di tempo. Si raccomanda di testare regolarmente la batteria e – se necessario – di ricaricarla completamente.
Desiderate ulteriori informazioni su questo argomento? Come si carica correttamente una batteria.
Nuove batterie: AGM e batterie agli ioni di litio
Anche se le batterie piombo-acido sono al momento le più diffuse, il mercato sta cambiando rapidamente: le nuove batterie per veicoli start-stop utilizzano acido assorbito in un materiale in fibra di vetro che garantisce una maggiore resistenza ai cicli e performance affidabili per moderni veicoli con maggior fabbisogno di energia elettrica. Un altro vantaggio delle batterie AGM: poiché l’acido è trattenuto, non si forma stratificazione.
L’ultima generazione di batterie per auto micro-hybrid utilizza addirittura sistemi a 48 V e tecnologia agli ioni di litio.