Hur fungerar ett bilbatteri och hur är det konstruerat?
Innehållsförteckning
Batteriets traditionella funktion under huven är välkänd: utan batteriet kan inte bilen starta. Utöver startmotorn behöver även tändstiften, glödstiften, belysningen och de elektroniska komponenterna elektrisk energi. Men hur är ett batteri konstruerat och hur fungerar det?
Blysyrabatterier: komponenter och konstruktion
Många förare blir medvetna om bilbatteriets tyngd först när de köper ett nytt. Ett bilbatteri kan väga från 10,5 kg ända upp till 30 kg. Orsaken är blyplattorna i batteriets celler.
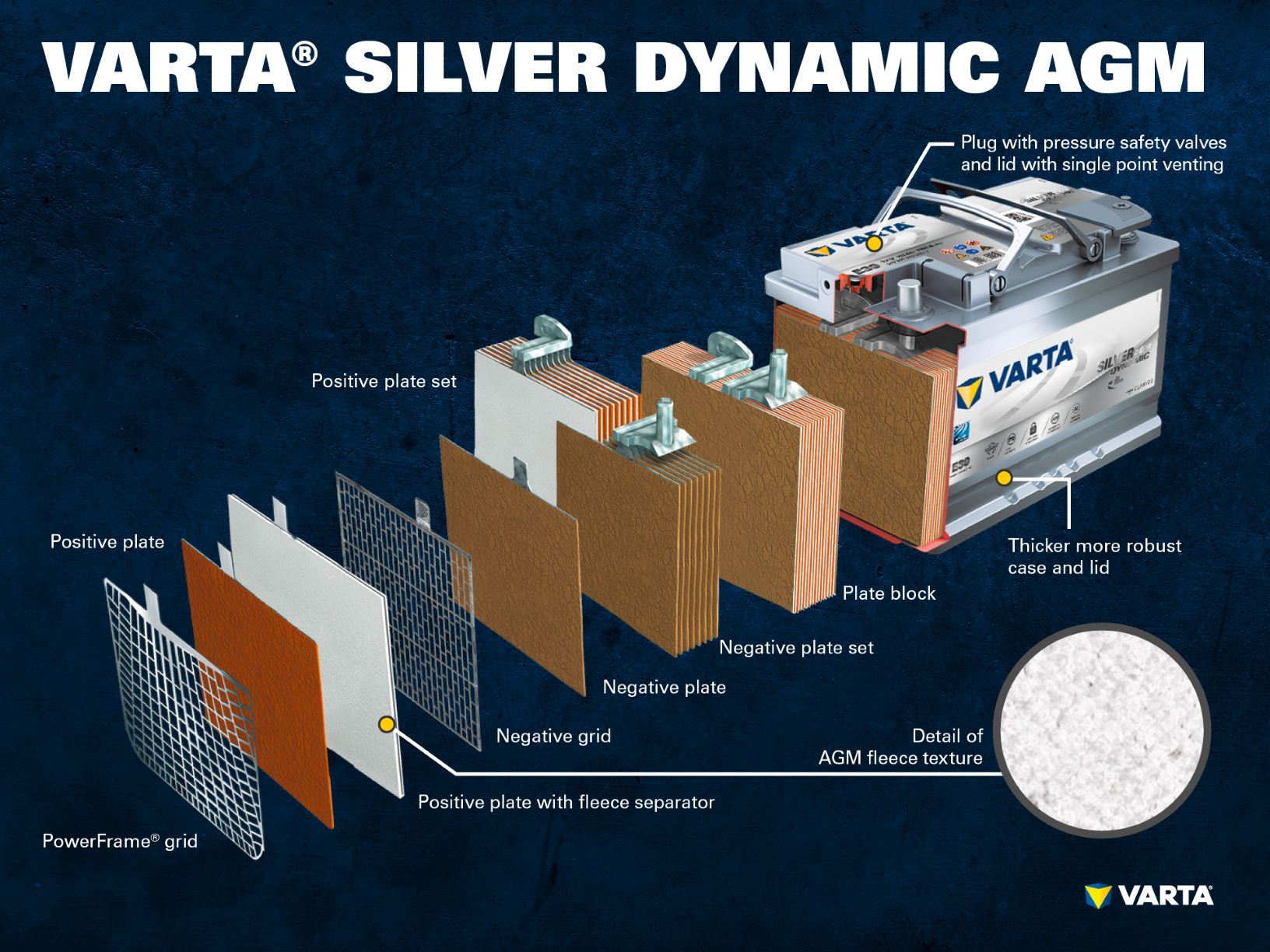
Batteriets komponenter och uppbyggnad
Positiv elektrod:
- Positiv platta: i ett blysyrabatteri består den positivt laddade plattan (det aktiva materialet) av blydioxid (PbO2) som sänks ner i en elektrolyt.
- Positivt galler: det positiva gallret består av en blylegering och används för att lagra det aktiva materialet och agera strömupptagare.
Negativ elektrod:
- Negativ platta: den negativt laddade plattan (det aktiva materialet) består av rent bly (Pb) som även det sänks ned i en elektrolyt.
- Negativt galler: precis som det positiva gallret består det negativa av en blylegering med samma funktion.
Elektroder med olika laddning hålls åtskilda av en separator.
Elektrolyten består av en blandning av svavelsyra (H2SO4) och destillerat vatten. Denna elektrolyt kan vara i vätskeform (som i konventionella vätskebatterier eller EFB-teknik), gelform eller inbunden i en glasfibermatta (som i AGM-teknik för nyare start-stopp-fordon).
Flera positiva elektroder bildar en positiv plattsats medan flera negativa elektroder bildar en negativ plattsats. Tillsammans bildar en negativ och en positiv plattsats ett elektrodblock. Ett elektrodblock utgör en battericell.
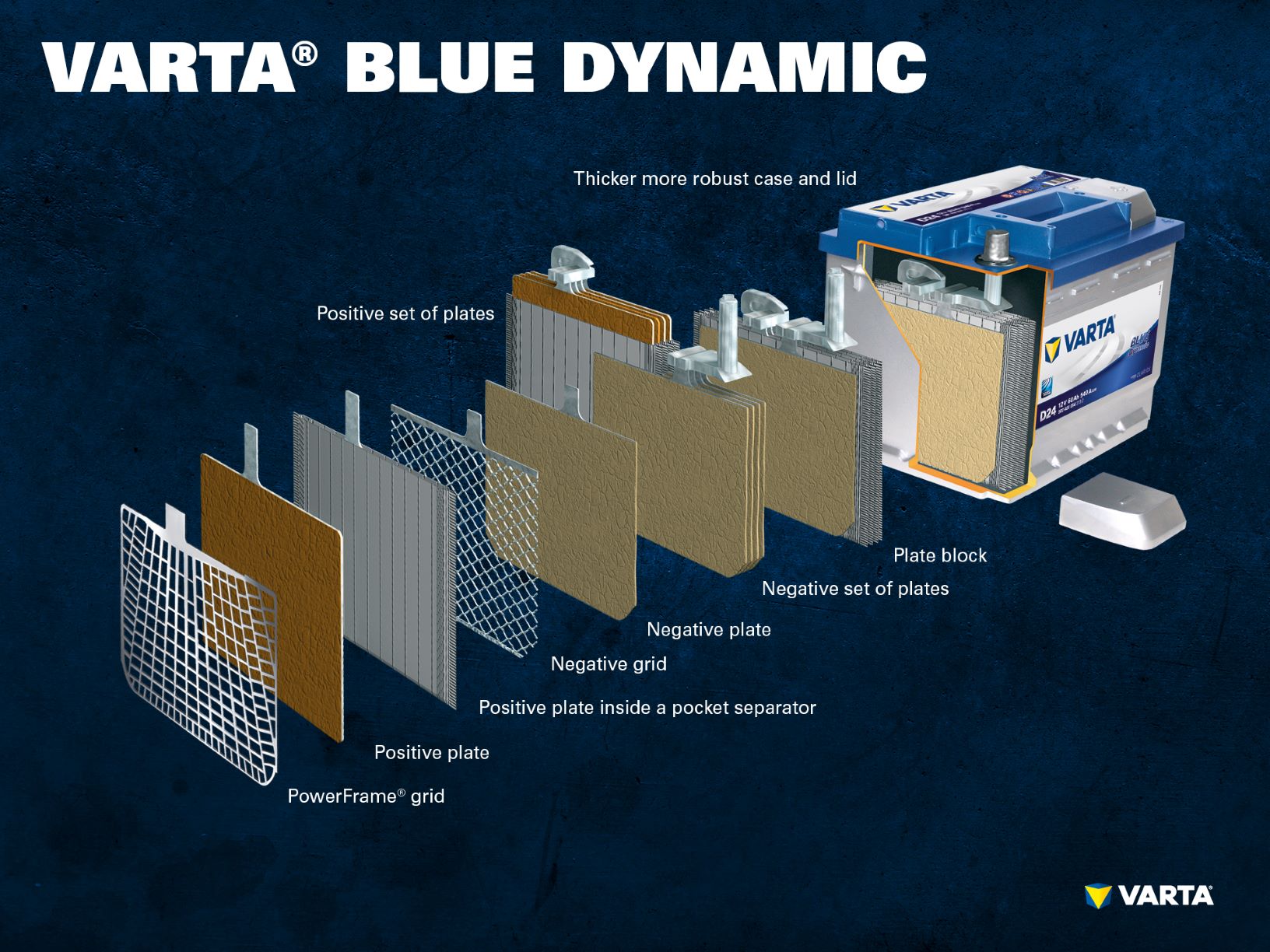
Ett konventionellt startbatteri består av 6 seriekopplade celler där varje enstaka cell har en nominell spänning på 2 V, vilket ger en spänning på exakt 12,72 V när batteriet är fulladdat. Batteriets kapacitet och kallstartström beror på antalet plattor per cell.
Cellerna sitter i ett hölje gjort av syrabeständig plast (polypropen). I ett konventionellt SLI-batteri är höljet inneslutet i ett labyrintsystem som förhindrar att batterivätskan läcker ut och separerar vätskan från gasen.
Tidiga batterier hade skruvpluggar som gjorde det möjligt att fylla batteriet med destillerat vatten. Moderna bilbatterier är helt underhållsfria. Man behöver inte – och bör inte – fylla på med vatten. Fastän AGM-batterier fortfarande har ”envägspluggar” får dessa inte öppnas under några omständigheter.
Bilbatteriets funktion: omvandlar kemisk energi till elektrisk energi
Ett bilbatteri lagrar kemisk energi som det sedan omvandlar till elektrisk energi. Denna elektrokemiska process inkluderar fyra ämnen som reagerar med varandra:
- Väte (H)
- Syre (O2)
- Bly (Pb)
- Svavel (S)
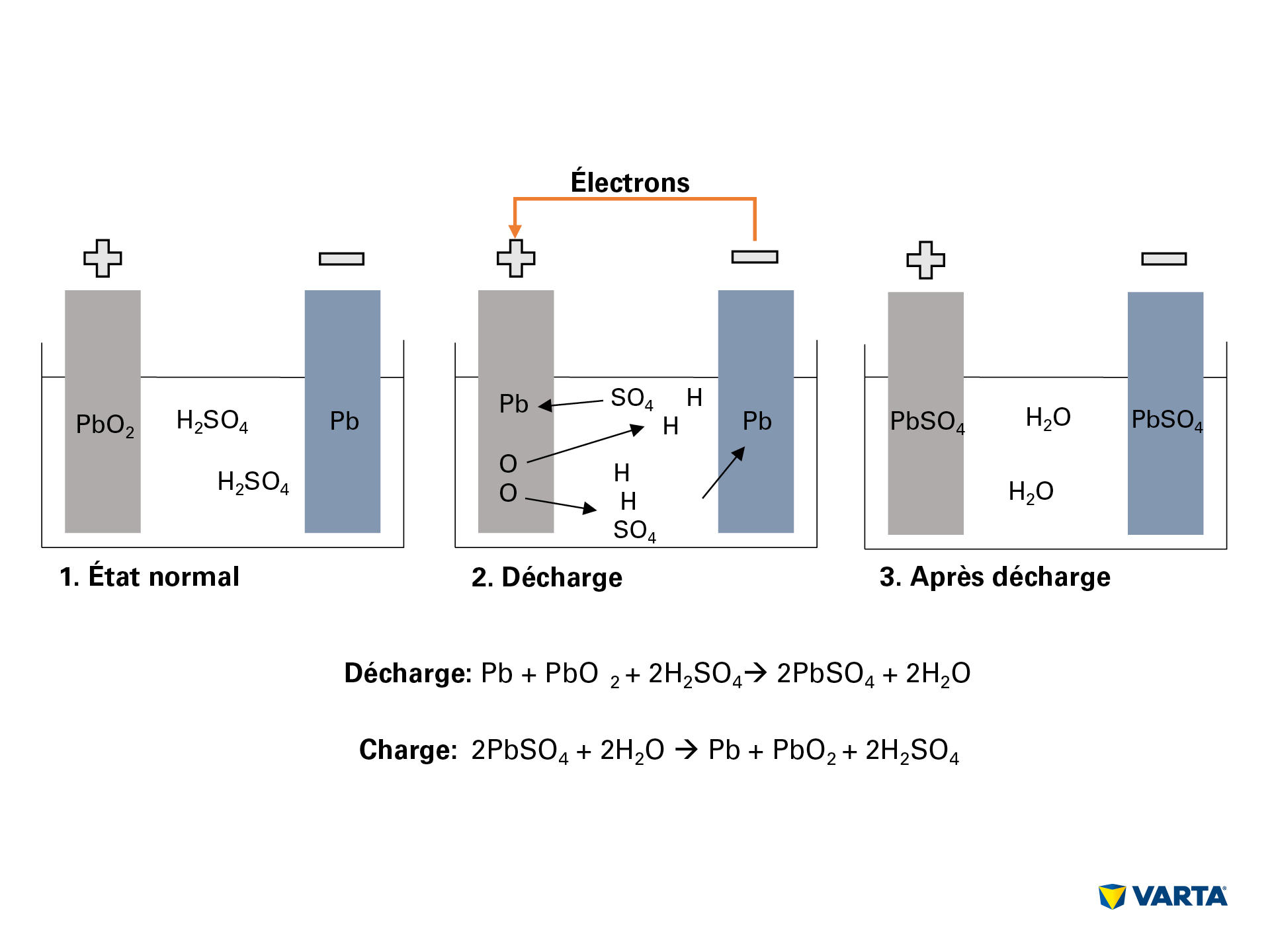
Den kemiska reaktionen uppstår så snart man kopplar ett externt föremål som behöver ström till batteriet:
- Elektrolyten, en blandning av svavelsyra (H2SO4) och vatten, delas upp i positivt laddade vätejoner (H+) och negativt laddade sulfatjoner (SO42-).
- Samtidigt rör sig elektroner (2e–) från den negativa till den positiva elektroden via den externa förbrukaren.
- För att kompensera för elektronernas flöde rör sig svaveljoner från elektrolyten in i den negativa elektroden där de reagerar med bly (Pb) och bildar blysulfat (PbSO4).
- Blysulfat bildas även i den positiva elektroden: bindningen av syre (O2) i blydioxiden (PbO2) bryts när elektronerna förflyttas, varefter syret rör sig in i elektrolyten. Det resterande blyet (Pb) binder till sulfatet (SO4) från elektrolyten.
- I elektrolyten binder syret till vätet och bildar vatten (H2O). I takt med att svavelsyran förbrukas till följd av blysulfatbildningen reduceras elektrolytens koncentration. När svavelsyrans koncentration har nått ner till en viss nivå måste batteriet laddas.
- Under laddningsprocessen sker den kemiska processen i omvänd ordning. I slutändan återfinns följande ursprungsämnen: den positiva elektroden består av blysulfat (PbSO4), den negativa elektroden av rent bly (Pb) och elektrolyten av utspädd svavelsyra (H2SO4).
Då denna omvandlingsprocess innebär en förlust kan ett batteri bara utstå ett begränsat antal laddningscykler. Dess brukbara liv är därför begränsat.
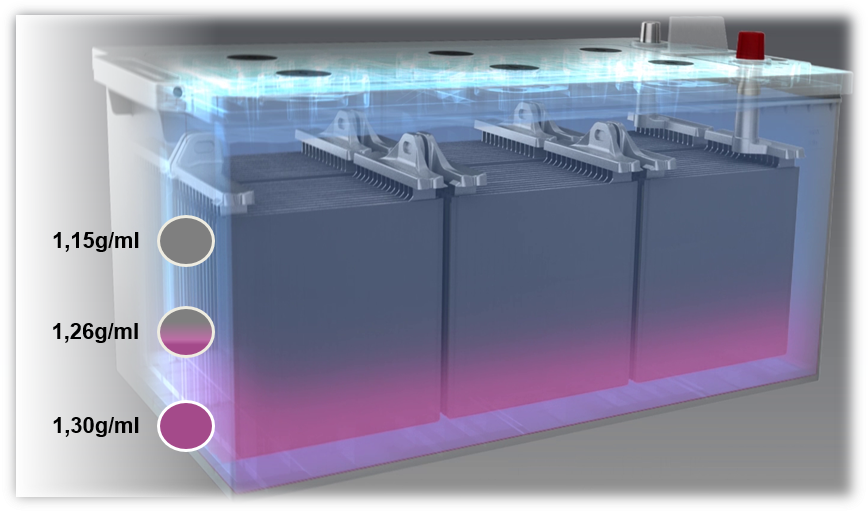
Problem med blysyrabatterier: sulfatbildning och syraskiktning
Om ett batteri laddas med en för låg spänning eller om det regelbundet används med för låg spänning (under 80 %) kan syraskiktning uppstå. Detta innebär att syran i elektrolyten skiktas till följd av undermålig blandning. Olika densiteter leder till att svavelsyran sjunker till botten medan vattnet flyter uppåt. Detta resulterar i sin tur i att endast en tredjedel av elektrolyten – dvs. delen i mitten – kan användas i upp- och urladdningsprocessen.
En potentiell orsak till syraskiktning är kortare resor i kombination med många elektriska förbrukare. I dessa fall hinner generatorn helt enkelt inte ladda upp batteriet igen.
Syraskiktning kan i sin tur orsaka sulfatbildning. Om detta uppstår, eller om batteriet alltför sällan laddas till 100 %, kristalliseras blysulfatet (PbSO4) på elektroderna. Med tiden bildas större och större kristaller. Denna process kallas ”sulfatbildning”. Kristalliseringen förhindrar att blysulfatet återuppdelas i bly eller blydioxid, vilket i sin tur hindrar laddningsacceptansen och reducerar kallstartströmmen.
Vassa kristaller kan dessutom skada separatorerna eller orsaka kortslutning i cellerna.
För att motverka denna effekt och förebygga att batteriets livslängd förkortas bör ett batteri aldrig utsättas för låga laddningsnivåer under en längre period. Därför är det rekommenderat att man testar batteriet regelbundet och laddar det fullt vid behov.
Vill du veta mer om det här ämnet? Så laddar du ett batteri.
Nya batteritekniker: AGM och litiumjonbatterier
Fram till idag har konventionella blysyrabatterier dominerat på marknaden. Faktum är att denna marknad dock håller på att förändras: innovativa batteritekniker för start-stopp-fordon som till exempel AGM använder syra innesluten i en glasfibermatta för att ge högre cyklingsstabilitet och garantera tillförlitlig prestanda i fordon med högre energikrav. Ytterligare en fördel med AGM är att risken för syraskiktning elimineras eftersom syran är inbunden.
Den nya generationens bilbatterier för mikrohybridfordon körs på 48 V och använder celler med litiumjonteknik.